Набор реагентов «Wheat streak mosaic virus-РВ»
Кат. № PH-049

Wheat streak mosaic virus (WSMV) – вирус полосатой мозаики пшеницы впервые выявлен в 1937 году (McKinney, 1937), первоначально был частью рода Rymovirus, после 1998 года из-за различий в структуре белка оболочки был отнесен к роду Tritimovirus, семейство Potyviridae (Stenger et al., 1998).
Вирус полосатой мозаики пшеницы – серьезное вирусное заболевание, поражающее как озимую, так и яровую пшеницу. Вирус имеет высокое фитосанитарное и экономическое значение. В зависимости от условий окружающей среды потери урожая варьируются от незначительных до полной гибели посевов. WSMV встречается во всех регионах мира, где выращивают пшеницу: Канада, США, Мексика, Европа, Китай, Иран, Иордания, Казахстан, Сирия, Турция, Узбекистан и Австралия.
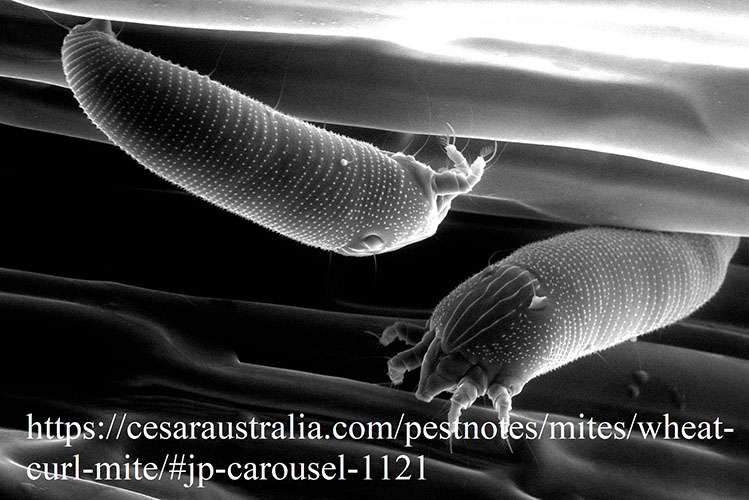
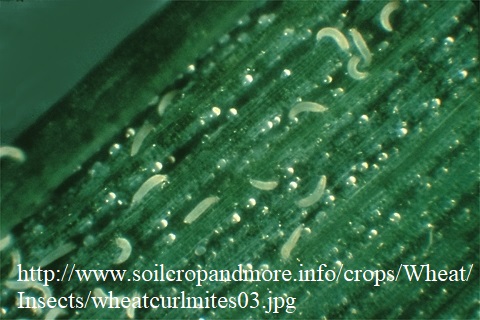
Существует два основных пути распространения вируса: зараженные семена, из которых вырастают инфицированные растения, и векторами. Главным образом вирус распространяется именно векторами - скручивающими клещами (Aceria tosichella и Aceria tulipae). Основным растением-хозяином для скручивающих клещей и WSMV является пшеница, но они обнаруживаются и на других культурных растениях, таких как кукуруза (Zea mays L), ячмень (Hordeum vulgare L), рожь (Secale cereale L) и сорго (Sorghum bicolor [L.] Moench), также встречаются на некоторых диких травах: Stipa spp., Aegilops spp., Setaria spp., Digitaria spp., Lolium spp., Bromus spp., Eriochloa spp.. Наибольшую опасность вирус полосатой мозаики пшеницы представляет для районов, где растения-хозяева растут круглый год.
Первые инфицированные растения чаще всего появляются на краю поля, когда клещи мигрируют с травянистых участков и культур, произрастающих по соседству. Начальный этап заражения характеризуется появлением мелких параллельных хлоротичных полос на поверхности листьев. По мере развития болезни симптомы прогрессируют, полосы удлиняются, образуя прерывистые желтые или бледно-зеленые линии, формирующие мозаичный узор на листьях. При более тяжелых формах инфекции линии сливаются, образуя большие хлоротичные участки, развивающиеся в некроз ткани листа и приводящие к гибели растения.
«ФИТОСКРИН» — технология быстрой молекулярно-генетической диагностики заболеваний растений методом ПЦР в реальном времени
«Wheat streak mosaic virus-РВ»
Набор реагентов предназначен для выявления РНК вируса полосатой мозаики пшеницы методом полимеразной цепной реакции в реальном времени совмещенной с реакцией обратной транскрипции (ОТ-ПЦР-РВ)
Диагностика растений на наличие вируса с помощью набора «Wheat streak mosaic virus-РВ» возможна на всех этапах его вегетационного развития методом полимеразной цепной реакции в реальном времени с обратной транскрипцией (ОТ-ПЦР-РВ).
Набор может быть использован в лабораторных центрах и институтах, проводящих контроль карантинного фитосанитарного состояния растений, в том числе посадочного материала в целях обнаружения РНК вируса полосатой мозаики пшеницы. Набор позволяет качественно определить, содержится ли в образце РНК Wheat streak mosaic virus.
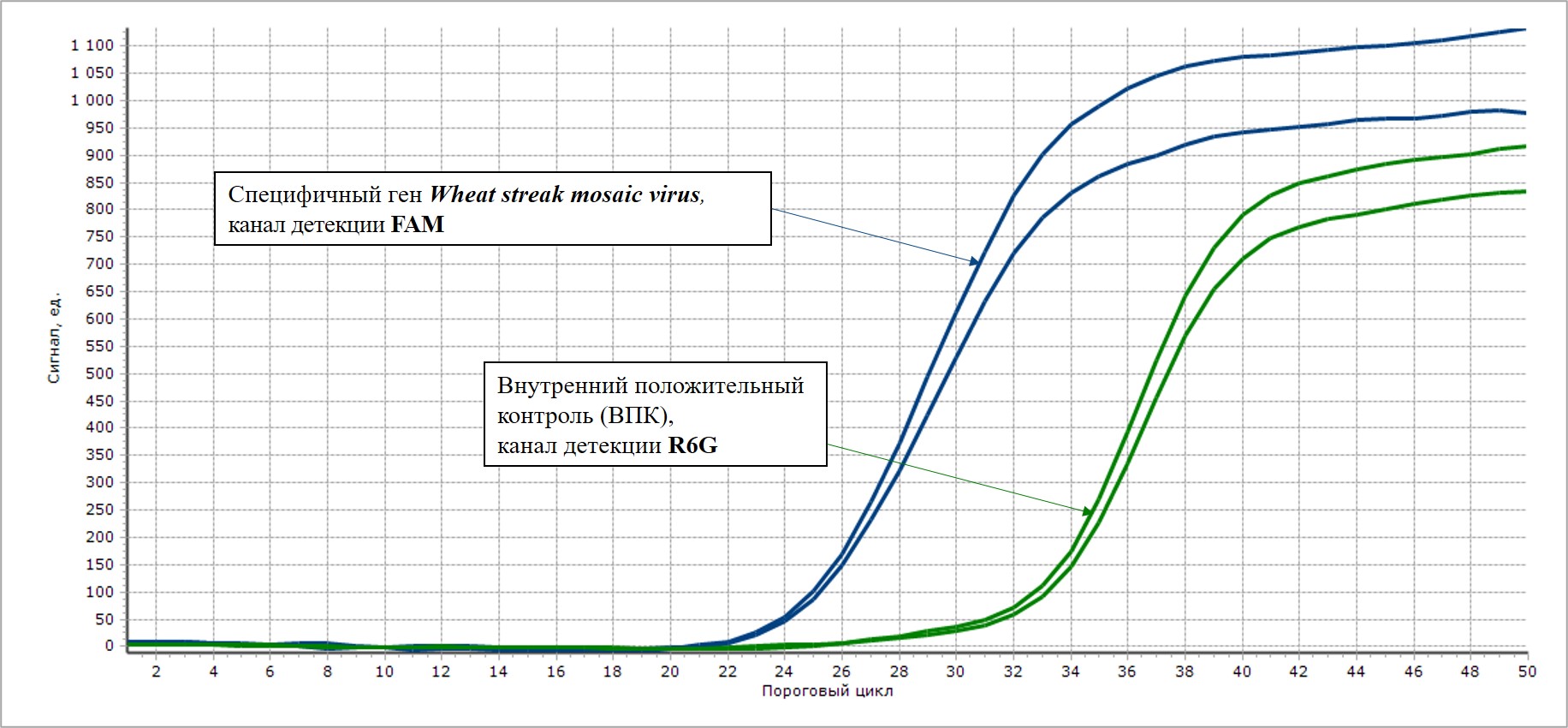
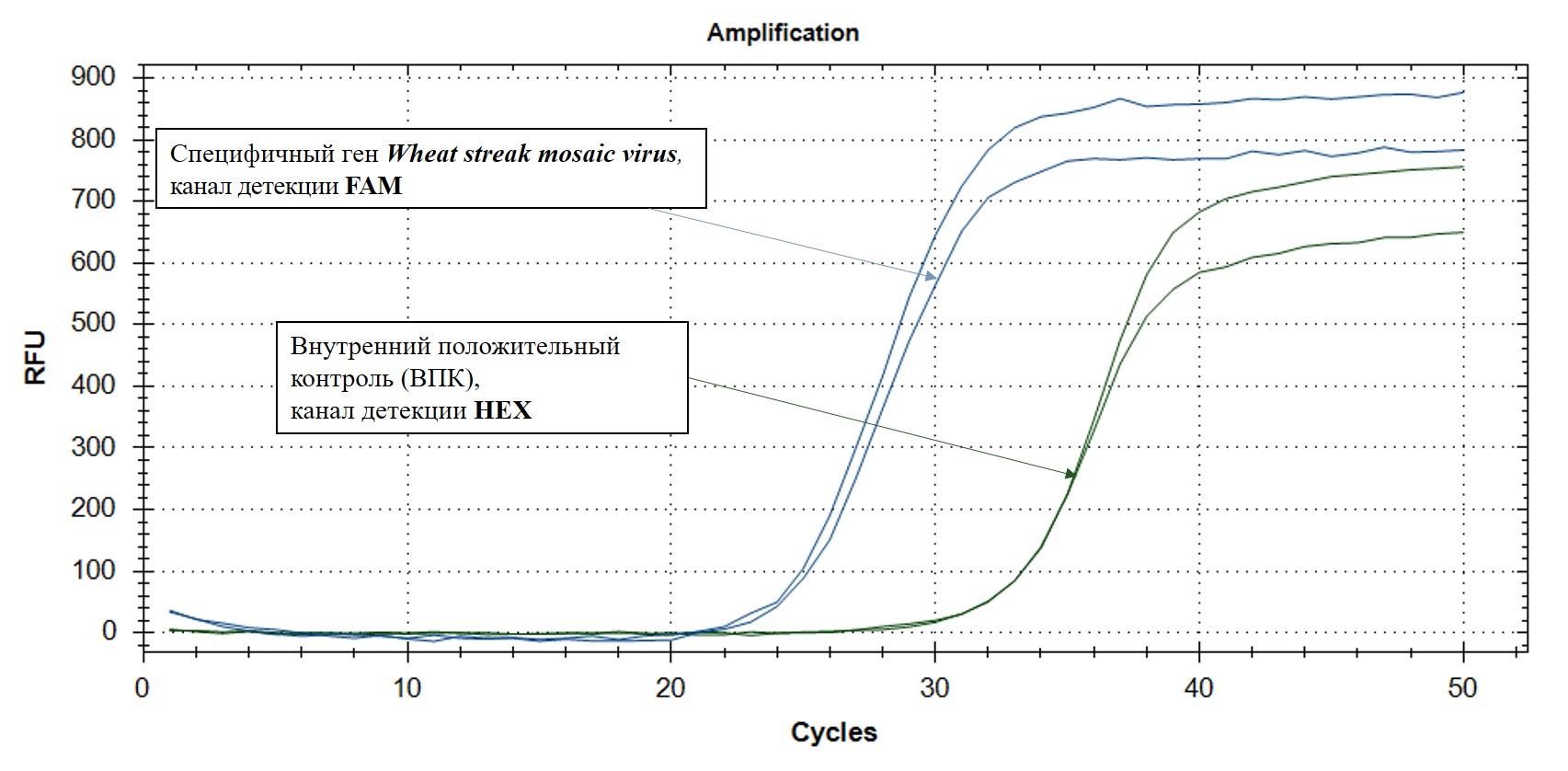
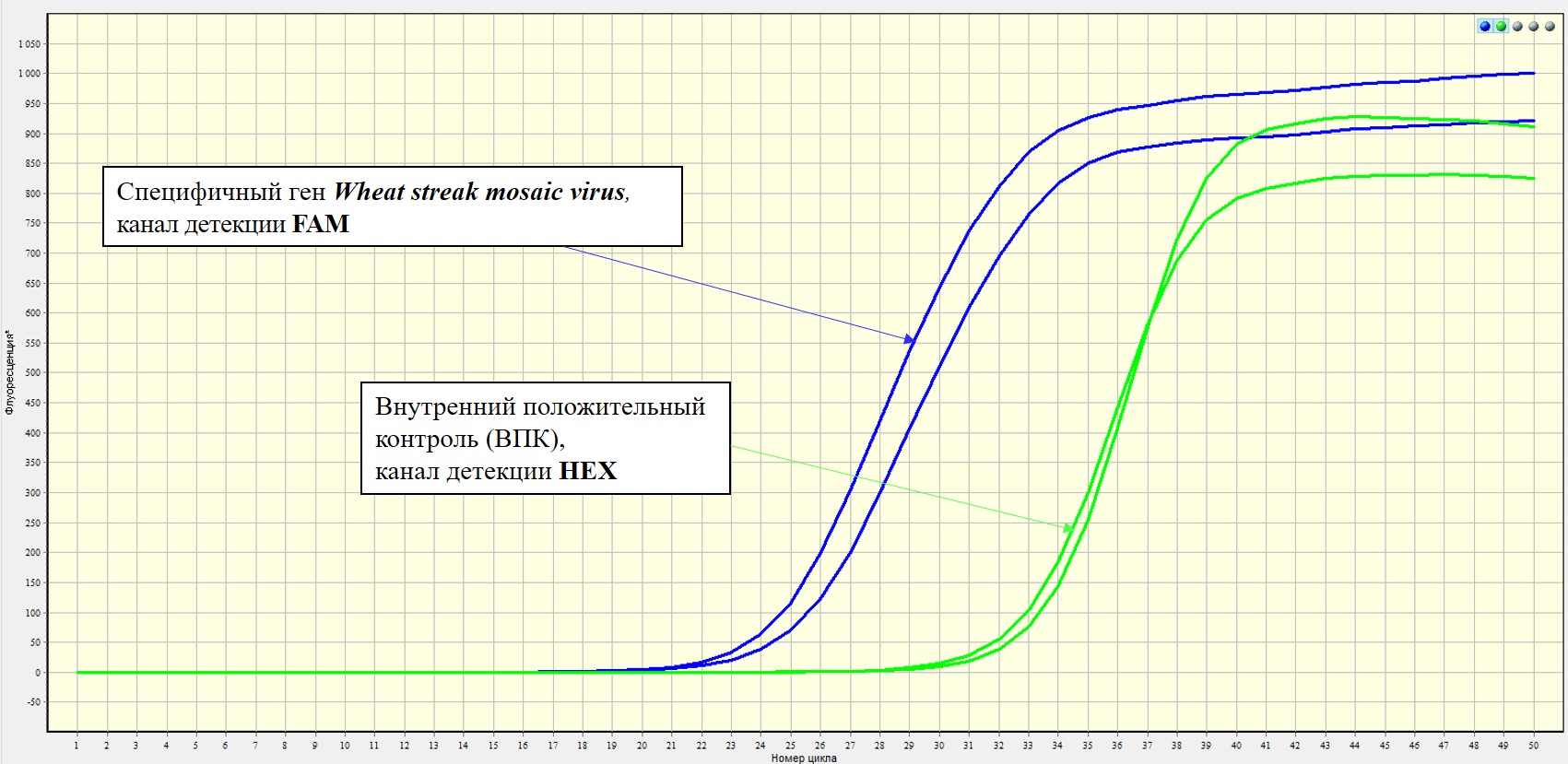
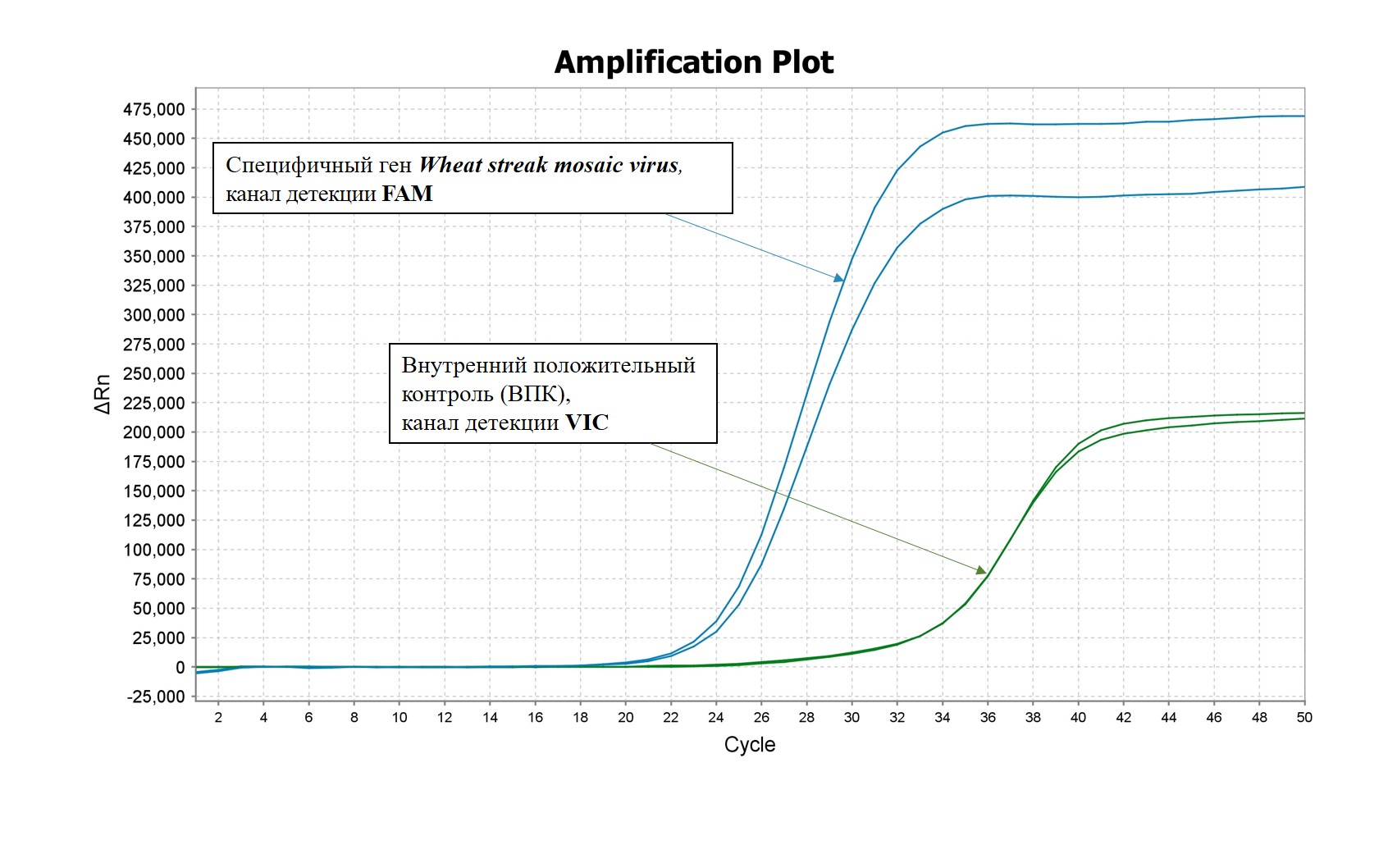
Проведение реакции обратной транскрипции и последующей мультиплексной ПЦР-РВ в наборе реагентов «Wheat streak mosaic virus-РВ» осуществляется последовательно в одной пробирке в течение одного запуска амплификатора без каких-либо дополнительных манипуляций. Набор реагентов «Wheat streak mosaic virus-РВ» позволяет одновременно выявлять в одной реакционной смеси специфичный фрагмент Wheat streak mosaic virus – FAM/Green, а также внутренний положительный контроль – по каналу флуоресценции R6G/HEX/Yellow.
Первая реакция позволяет обнаружить последовательность специфического фрагмента РНК вируса полосатой мозаики пшеницы. Вторая реакция – ВПК (Внутреннего Положительного Контроля) – необходима для исключения ложноотрицательных результатов.
- Специфичность
Специфичность – ложноотрицательные результаты при анализе образцов растений, содержащих РНК вирусов, отсутствовали, ложноположительные результаты при анализе образцов ДНК растений и РНК вирусов, не содержащих вышеперечисленные специфические фрагменты, отсутствовали.
Набор реагентов апробирован на следующих приборах: «АНК-32 (32М, 48)» (ИАП РАН, г. Санкт-Петербург, Россия), «CFX96» («BioRad», США), «Rotor Gene» (Qiagen), «DT» («ДНК-технология», Россия), QuantStudio 5 (Thermo Fisher Scientific, США).