Набор реагентов «Phytophthora ramorum-РВ»
Кат. № PH-050
Phytophthora ramorum – опасный фитопатогенный гриб вызывающий фитофтороз древесных и кустарниковых культур. P. ramorum входит в список А2 перечня вредителей Европейской и Средиземноморской организации по карантину и защите растений (EPPO, 2013).
Предположительно центром происхождения вида P. ramorum является Вьетнам, откуда этот вид был интродуцирован в Европу и Северную Америку (Jung et al.,2020). На сегодняшний день P. ramorum встречается в Бельгии, Хорватии, Дании, Финляндии, Франции, Германии, Греции, Ирландии, Люксембурге, Нидерландах, Норвегии, Польше, Португалии, Сербии, Словении, Швейцарии, Великобритании, Вьетнаме, Канаде, США.
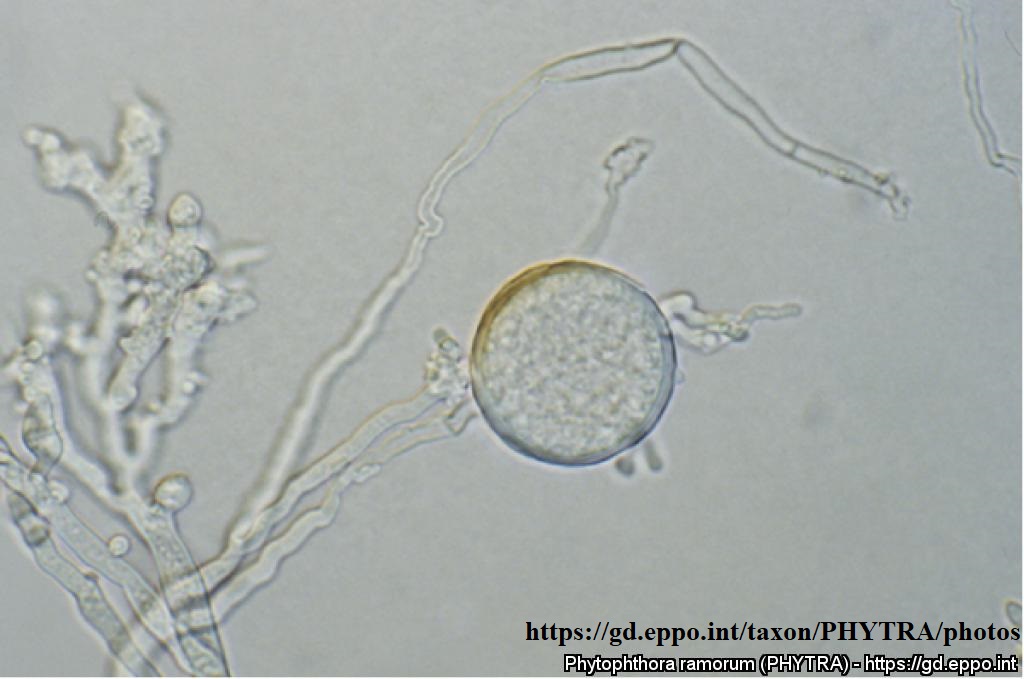
Важную роль в распространении патогена играет мицелий, способный образовывать споры трех различных типов: зооспоры, спорангии и хламидоспоры. Другой способ инфицирования – зараженная почва или питательный субстрат. Патоген колонизирует проводящую систему растений.

Характерными симптомами поражения P. ramorum являются: наличие на стволе деревьев смолистых пятен или язв; появление некротизированных обесцвеченных тканей коры. Окклюзия сосудов, вызванная данным патогеном, часто приводит к увяданию листьев/хвои и, в конечном итоге, к гибели растения. Поражение ветвей начинается с кончиков и по мере прогрессирования инфекции движется к их основанию. Язвы могут появляться на побегах, стеблях и способны приводить к быстрому увяданию листьев, при этом увядшие листья не отпадают. Другим важным симптомом является появление небольших коричневых или черных пятен на листовой пластине, при этом со временем площадь поражения разрастается и охватывать весь лист целиком. В этом случае листья могут преждевременно опадать (Bulletin OEPP/EPPO, 2006:36).
P.ramorum способен нанести существенный экономический ущерб лесам и питомникам. Ситуацию осложняет наличие широкого круга растений-хозяев, поскольку виды растений, формирующих подлесок (например, Laurus nobilis) также могут быть инфицированы P. ramorum и способствуют его выживанию и сохранению (Grünwald et al., 2019). В настоящее время известно более 170 видов, поражаемых данным патогеном, к ним относятся кустарники и деревья, а также некоторые травянистые растения: Camellia, Kalmia latifolia, Larix, Lithocarpus densiflorus, Quercus agrifolia, Pieris, Rhododendron, Syringa vulgaris, Vaccinium and Viburnum (Bulletin OEPP/EPPO, 2006:36).
«Phytophthora ramorum-РВ»
Набор реагентов для выявления ДНК возбудителя фитофтороза древесных и кустарниковых культур методом полимеразной цепной реакции в реальном времени
Набор может быть использован в лабораторных центрах и институтах, проводящих контроль фитосанитарного состояния растений, в том числе посадочного материала в целях обнаружения Phytophthora ramorum. Набор позволяет качественно определить, содержится ли в образце ДНК Phytophthora ramorum.
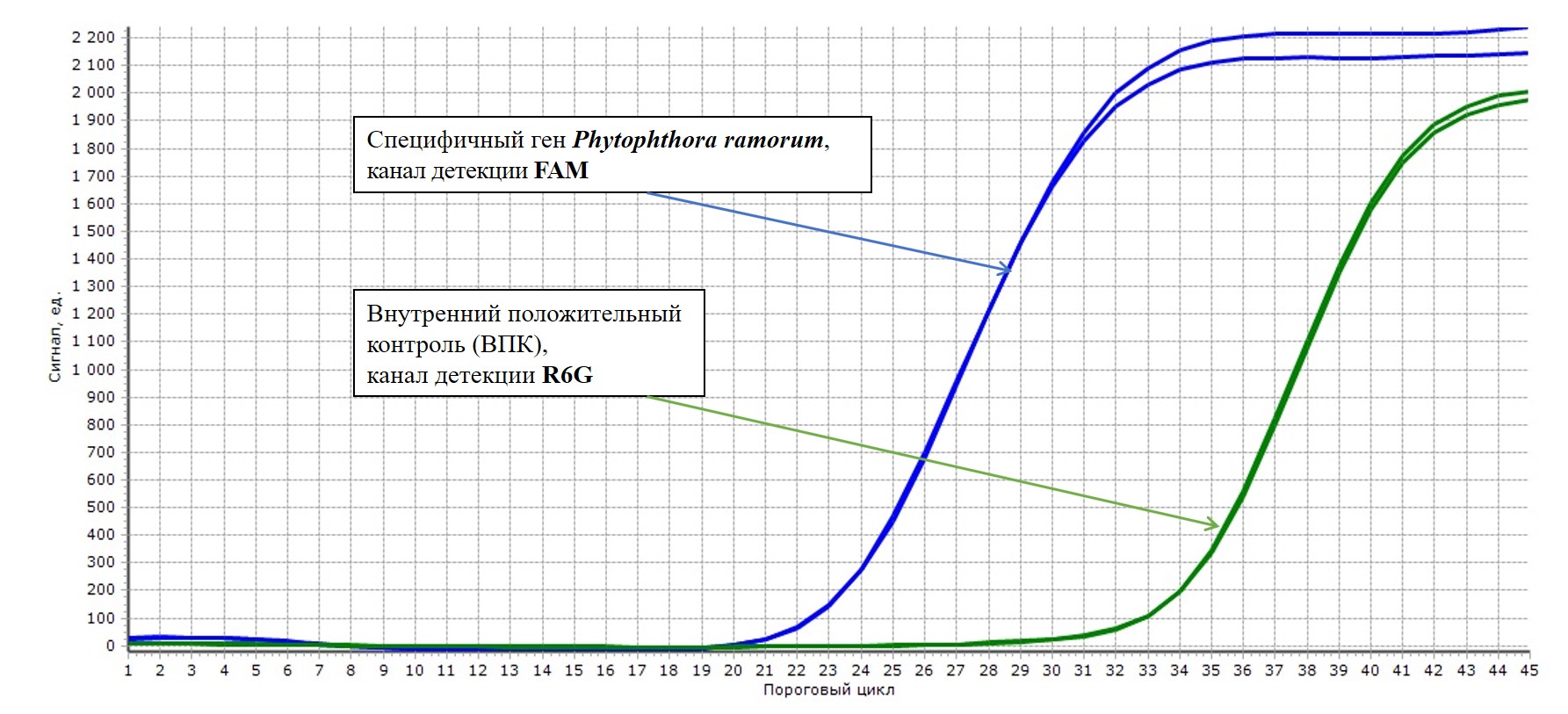
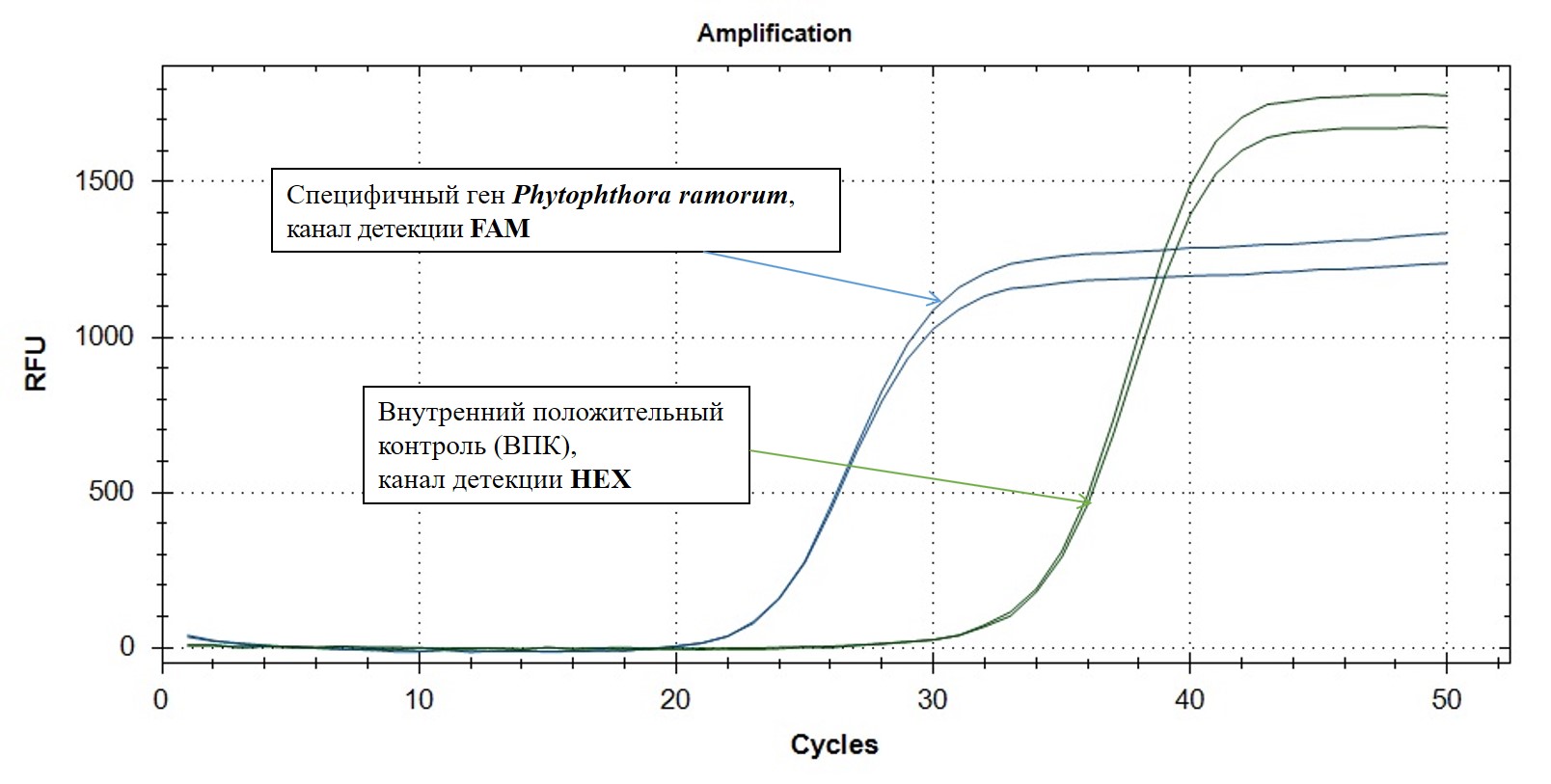
Набор реагентов «Phytophthora ramorum-РВ» позволяет одновременно выявлять в одной реакционной смеси специфичный фрагмент ДНК Phytophthora ramorum – по каналу флуоресценции FAM/Green, а также внутренний положительный контроль (ВПК) – по каналу флуоресценции R6G/HEX/Yellow/VIС. Реакция ВПК необходима для исключения ложноотрицательных результатов.
- Специфичность
Набор реагентов выявляет возбудителя фитофтороза древесных и кустарниковых культур Phytophthora ramorum, а также Phytophthora foliorum, растением-хозяином которого является азалия, Rhododendron sp.
Специфичность – ложноотрицательные результаты при анализе образцов, содержащих ДНК целевого объекта, отсутствовали, ложноположительные результаты при анализе образцов ДНК, не содержащих вышеперечисленные специфические фрагменты ДНК Phytophthora ramorum и Phytophthora foliorum, отсутствовали.Как подтверждающий метод, для идентификации возбудителя фитофтороза древесных и кустарниковых культур Phytophthora ramorum, рекомендуем использовать метод секвенирования, на праймерах, рекомендуемых EPPO (PM 7/66 (1)) – ITS1: 5′-TCC GTA GGT GAA CCT GCG G-3′
ITS 4: 5′-TCC TCC GCT TAT TGA TAT GC-3′ (Whiteet al., 1990).С помощью метода секвенирования с указанными праймерами можно тестировать только ДНК из чистых культур, в противном случае в той же реакции могут быть амплифицированы последовательности из нескольких организмов.
Набор реагентов апробирован на следующих приборах: «АНК-32 (32М, 48)» (ИАП РАН, г. Санкт-Петербург, Россия), «CFX96» («BioRad», США), «Rotor Gene» (Qiagen), «DT» («ДНК-технология», Россия), QuantStudio 5 (Thermo Fisher Scientific, США).